Programme PLUSRx : Pharmacothérapie liée à l’utilisation sécuritaire des médicaments
Pauline Rault, Amélie Duhamel, Dana Necsoiu, Isabelle Desjardins, Denis Lebel, Jean-François Bussières
INTRODUCTION
Avec l’entrée en vigueur de la réglementation entourant la Loi de Vanessa, les établissements de santé du Canada et les départements de pharmacie de ces établissements sont contraints de respecter cette nouvelle exigence1,2. Entrée en vigueur en 2019, cette modification législative oblige tout établissement de soins de santé de fournir en bonne et due forme au ministre, dans les 30 jours suivant la consignation par l’hôpital des médicaments incriminés et selon les modalités réglementaires, les renseignements sur les réactions indésirables graves à une drogue, qui relèvent de l’autorité ministérielle3. Les réactions indésirables à une drogue sont jugées graves si elles entrainent une malformation congénitale, une invalidité, une incapacité, une mise en danger ou la mort.
Bien que le pharmacien soit un expert du médicament, la pharmacovigilance ne présente qu’une seule dimension de ses activités professionnelles. Dans le rapport sur les pharmacies hospitalières canadiennes de 2016–2017, on note la participation du pharmacien à des activités de surveillance et à la déclaration des effets indésirables aux médicaments (EIM) dans 71% (131/184) des établissements. Toutefois, seulement 21% (39/184) des établissements le font dans tous leurs secteurs de soins. En outre, 41% (58/141) des établissements de soins de santé s’appuient sur le travail des techniciens en pharmacie pour aider à réunir les données à présenter au comité de pharmacovigilance4. Les données canadiennes indiquent une couverture partielle en matière de pharmacovigilance. L’absence de structure qui cadre avec la pharmacovigilance n’encourage pas les pharmaciens hospitaliers à effectuer la notification des EIM à Santé Canada.
Au sein de notre établissement, l’équipe du Département de pharmacie a mis en place en 2006 un programme structuré de pharmacovigilance (PLUSRx – pharmacovigilance liée à l’utilisation des médicaments). Dans la foulée des changements législatifs, nous pensons qu’il est utile de faire connaitre ce programme afin de soutenir les départements de pharmacie au Canada.
Il s’agit d’une étude descriptive transversale. L’objectif principal était de décrire et d’évaluer l’ensemble des activités du programme PLUSRx mis en place au Centre hospitalier universitaire (CHU) Sainte-Justine.
DESCRIPTION DU PROGRAMME
Le CHU Sainte-Justine est un centre hospitalier universitaire mère-enfant de 500 lits. L’établissement compte un effectif de 36,4 équivalents-temps-plein pharmaciens (ETP) ou 40 pharmaciens employés par l’établissement, de 50 ETP assistants techniques séniors en pharmacie et de quatre résidents en pharmacie hospitalière chaque année.
Depuis le milieu des années 1990, nous avons progressivement ajouté des pharmaciens en les décentralisant dans les programmes de soins hospitaliers et certains programmes de soins ambulatoires afin de prodiguer des soins pharmaceutiques complets. Ce type de soins comporte notamment la prévention et la gestion des EIM en collaboration avec les médecins, les infirmières et surtout le patient. Cette transition vers les soins offerts aux patients a contribué à limiter l’intérêt pour les fonctions transversales de la part des jeunes pharmaciens diplômés qui ont été embauchés. Malgré cet attrait pour les soins, qui a permis à un plus grand nombre de patients de profiter des services du pharmacien dans la gestion des EIM, la déclaration à Santé Canada est restée limitée, compte tenu de la priorité accordée à l’activité de notification et le temps dont disposee l’équipe de pharmacovigilance. C’est pourquoi, dès 2006, nous avons choisi de structurer progressivement un programme transversal de soutien à la pharmacovigilance. Le programme PLUSRx a d’abord été bâti autour de résidents en pharmacie (volet international) sous la supervision de pharmaciens dans le cadre d’une résidence en pharmacovigilance de 12 mois. Durant quelques années, cette résidence était offerte à des internes en pharmacie hospitalière de France. Leur contribution a permis de structurer l’activité. Aujourd’hui, le Programme repose sur une équipe pluridisciplinaire constituée de deux ETP (détentrices d’un baccalauréat en sciences biopharmaceutiques). Ces ressources sont financées en partie par l’établissement et le reste du financement est pris en charge par le Canadian Pharmacogenomic Network for Drug Safety (CPNDS [Réseau canadien de surveillance en pharmacogénomique]). Cette équipe oeuvre sous la responsabilité du pharmacien-chef adjoint aux soins, à l’enseignement et à la recherche. Elle collabore avec tous les pharmaciens du Département, l’équipe de la Direction qualité-risque et le Service des archives médicales (deux archivistes sont en relation directe avec l’équipe de pharmacovigilance).
De plus, la mise en place du programme PLUSRx a également permis de participer au CPNDS qui mène différents projets de recherche visant à déterminer des polymorphismes prédicteurs d’EIM chez les enfants5.
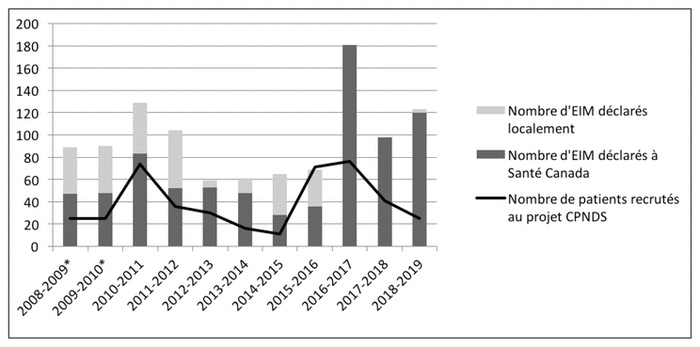
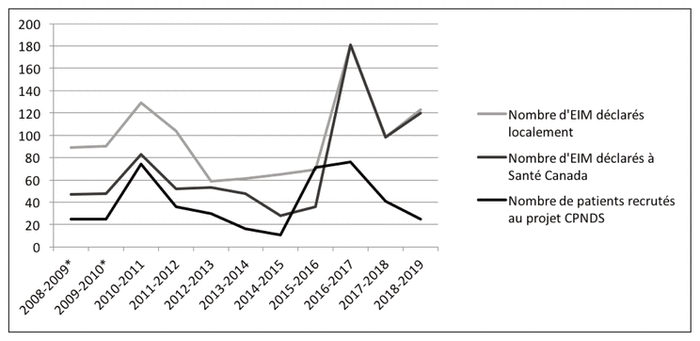
Ainsi, au cours des dix dernières années du Programme, l’équipe de soutien à la pharmacovigilance a déclaré localement 1068 EIM. La figure 1 présente le profil du nombre de déclarations locales d’EIM, du nombre de déclarations d’EIM à Santé Canada et du nombre de patients recrutés dans le programme CPNDS du 1er avril 2008 au 31 mars 2019. De plus, une majorité (74,3 %, 794/1068) de ces EIM a été rapportée à Santé Canada. Dix rapports de cas ont été publiés dans la littérature pharmacologique. En outre, durant cette même période, 36 228 activités de type « pharmacovigilance » ont été réalisées par les pharmaciens décentralisés dans les programmes de soins, ce qui correspond à environ neuf interventions de pharmacovigilance par jour. Une activité de pharmacovigilance correspond à une action de détection d’un EIM par le pharmacien ou à sa prise en charge (p. ex. modification de posologie d’un médicament, substitution par un autre médicament, aide à la gestion des conséquences cliniques de l’EIM, etc.); elle peut également impliquer une déclaration locale ou à Santé Canada. On s’attend à ce qu’une majorité des activités de pharmacovigilance comptabilisées par le journal de bord et réalisées par les pharmaciens visent à prévenir la survenue des EIM et à en assurer la prise en charge, et un nombre limité de ces activités mènent à une déclaration d’EIM graves faite à Santé Canada. La figure 2 présente le profil du nombre d’activités de pharmacovigilance (c.-à-d. EIM évités ou pris en charge) par les pharmaciens cliniciens dans les différents programmes de soins au CHU Sainte-Justine du 1er avril 2008 au 31 mars 2019. De plus, de nombreux travaux de recherche ont été menés localement afin de mieux comprendre les caractéristiques des EIM à déclarer et leur gestion6–10.
| |
|
|
|
Figure 1 Profil du nombre de déclarations locales d’effets indésirables médicamenteux (EIM), du nombre de déclarations d’EIM à Santé Canada et du nombre de patients recrutés dans le programme CPNDS (Réseau canadien de surveillance en pharmacogénomique) du 1er avril 2008 au 31 mars 2019.
|
| |
|
|
|
Figure 2 Profil du nombre d’activités de pharmacovigilance (c.-à-d. effets indésirables médicamenteux [EIM] évités ou pris en charge) par les pharmaciens cliniciens dans les différents programmes de soins au CHU Sainte-Justine du 1er avril 2008 au 31 mars 2019.
|
ÉVALUATION DU PROGRAMME
En 2019, nous avons mené une évaluation du programme PLUSRx auprès des pharmaciens du Département de pharmacie de l’établissement. Elle visait à vérifier auprès des pharmaciens leur connaissance du Programme et à recueillir leurs commentaires. Un sondage en ligne (Surveymonkey, San Matteo [Californie]) a été élaboré par l’équipe de recherche (CHU Sainte-Justine). Il comportait deux parties, soit le profil des répondants (nombre d’années d’expérience du répondant, domaine d’expertise et nombre d’EIM auxquels il a été confronté durant la dernière année financière [2018–2019]) et la mesure de la satisfaction des pharmaciens relative aux activités du programme PLUSRx. L’échelle de Likert utilisée à cet effet comptait cinq choix (totalement satisfait, partiellement satisfait, partiellement insatisfait, totalement insatisfait et non applicable pour ceux qui ne connaissaient pas l’existence de l’activité en question).
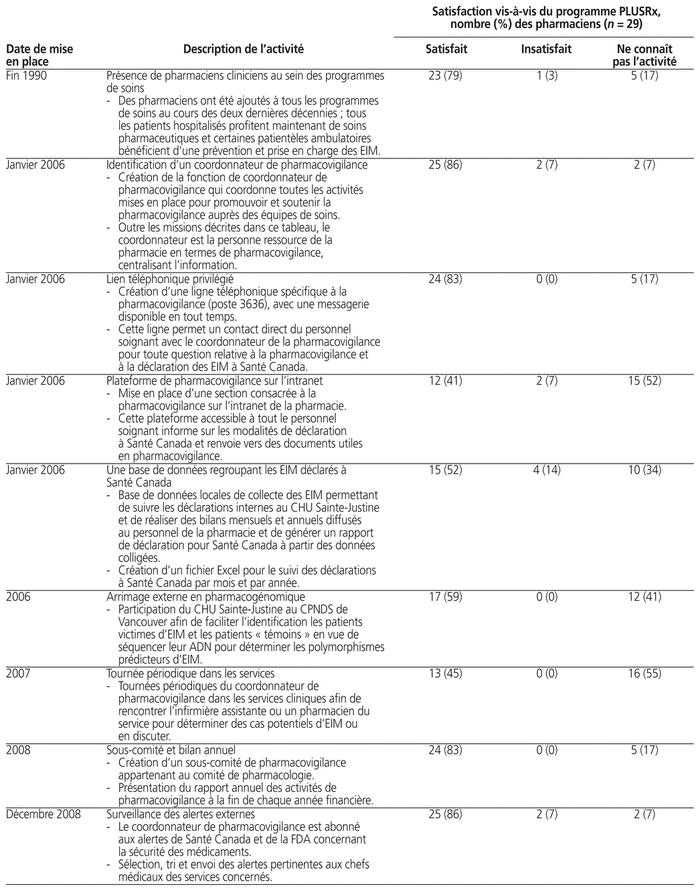
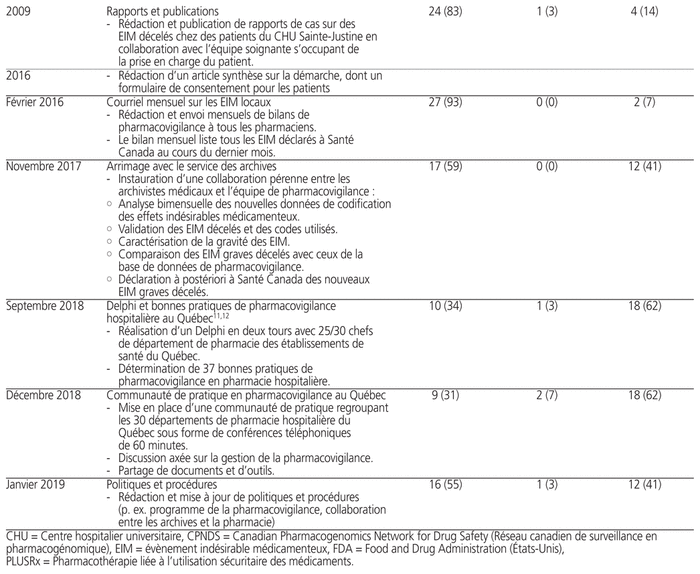
Les investigateurs ont reçu les réponses de 29 pharmaciens (29/37, 78 %). Quinze (15/29, 52 %) d’entre eux exerçaient au CHU Sainte-Justine depuis plus de 10 ans. Les pharmaciens ayant répondu provenaient de l’équipe de pédiatrie (12/29, 41 %), d’hémato-oncologie (4/29, 14 %), de mère-enfant (5/29, 17 %) et de l’équipe de gestion (8/29, 28 %). Au cours de l’exercice de 2018–2019, les pharmaciens ont dit avoir été exposés à une médiane de neuf EIM graves et avérés à l’étage (min. : 0; max. : 2000), à aucun EIM grave à l’étage (min. : 0; max. : 250) et ont participé à la déclaration d’une médiane d’un EIM (min. : 0; max. : 10). Les pharmaciens ont toutefois participé à un grand nombre d’activités visant à prévenir la survenue d’EIM ou à assurer la prise en charge d’EIM sans gravité. Le tableau 1 présente un profil chronologique croissant des activités du programme PLUSRx ainsi que le degré de satisfaction des pharmaciens vis-à-vis de chacune des activités.
Tableau 1 Profil chronologique croissant des activités du programme de pharmacovigilance PLUSRx ainsi que le degré de satisfaction des pharmaciens vis-à-vis de chacune des activités
DISCUSSION
Cette étude descriptive présente un programme original de pharmacovigilance (PLUSRx) géré par des pharmaciens hospitaliers dans un établissement de santé au Canada.
Dans la littérature canadienne, il n’existe pas d’exemples similaires qui présentent un programme global incluant une variété d’activités de soins et de soutien. Toutefois, plusieurs études confirment la capacité des pharmaciens à prévenir, déceler et prendre en charge ou à déclarer les EIM et, au cours des dernières années, la littérature démontre un intérêt croissant entourant l’évaluation de tels programmes. Par exemple, He et collab.13 ont démontré l’intérêt de décentraliser les pharmaciens dans les équipes de soins tertiaires et de les faire participer aux tournées de patients afin d’accroître la détection et la déclaration des EIM. Van Grootheest et de Jong-van den Berg14 ont commenté la contribution essentielle des pharmaciens hospitaliers et communautaires à la prévention, à la prise en charge et à la déclaration des EIM aux Pays-Bas. Phansalkar et collab.15 ont mené une méta-analyse portant sur 13 études. Elle confirme la supériorité des pharmaciens par rapport à d’autres professionnels (c.-à-d. médecins, infirmières et archivistes médicaux) pour la détection rétrospective d’EIM à partir de dossiers patients15. Yu et collab.16 se sont intéressés aux EIM sévères détectés dans un hôpital pédiatrique de janvier 2011 à septembre 2014. Les auteurs ont mis en évidence un programme de pharmacovigilance placé sous la responsabilité des pharmaciens, ayant permis la détection de 166 EIM graves survenus chez 163 patients. Morales Ríos et collab.17 ont décrit un programme hospitalier de pharmacovigilance dans un établissement pédiatrique du Mexique, ayant eu un impact positif sur la détection et la déclaration des EIM. Leur programme a permis la transition de la déclaration des EIM d’un système papier à un système informatisé plus efficient17. Notre étude illustre la faisabilité d’implanter et de maintenir un programme de pharmacovigilance qui soutienne la prestation de soins pharmaceutiques offerts par les pharmaciens cliniciens dans les programmes de soins. Le Programme est original, notamment avec l’arrimage de la pharmacie au service des archives et les nouvelles stratégies de codification des EIM, la détermination des bonnes pratiques et la mise en place d’une communauté de pratique au Québec.
La description de notre programme met en évidence une hausse du nombre d’EIM décelés, déclarés localement et à l’autorité réglementaire parallèlement à l’augmentation du nombre d’activités mises en place dans le cadre du Programme. Toutefois, nous avons atteint un plateau depuis quelques années. Terblanche et coll. ont démontré l’impact favorable d’un tel programme sur les pratiques de déclaration des EIM (c.-à-d. hausse de 12,1% à 33,8% des professionnels de la santé concernés par au moins une déclaration d’EIM) après la mise en place d’un programme de pharmacovigilance géré par les pharmaciens18. Guédat et collab.19 ont rapporté également une hausse (jusqu’à 10 fois) de la déclaration des EIM avec la mise en place d’un programme de pharmacovigilance dans un centre hospitalier universitaire en France. Un programme structuré peut contrer les barrières à la déclaration20. Dans notre centre, la présence de pharmaciens dans toutes les unités de soins a sans doute facilité la mise en place du programme PLUSRx. Il demeure toutefois possible d’implanter une structure centralisée favorisant la déclaration des EIM graves sans pour autant qu’il y ait une couverture en soins pharmaceutiques à l’échelle de l’établissement.
Bien que le Programme ait été mis en place progressivement depuis 2006, l’évaluation menée a montré la méconnaissance de quelques pharmaciens de certaines activités. On remarque que les étapes moins connues n’impliquent pas la participation directe du pharmacien. D’autres facteurs expliquent cette méconnaissance, notamment la rotation annuelle des résidents en pharmacie qui participent au Programme, l’inexpérience de certains répondants, l’importance accrue accordée à la prise en charge clinique des EIM, plutôt qu’à leur déclaration locale ou à Santé Canada ou encore l’implantation récente de certaines activités (p. ex. bonnes pratiques de pharmacovigilance, communauté de pratique). À la suite de cette évaluation, nous avons davantage abordé ce sujet en réunion et l’avons discuté afin de pallier la méconnaissance qu’ont certains pharmaciens de l’ensemble des activités de pharmacovigilance mises en place au sein de l’établissement.
Cette étude comporte des limites. Par exemple, elle ne décrit pas en détail les modalités de détection, d’analyse et de déclaration des EIM. Chacune de ces étapes comporte plusieurs modalités. La mise en place d’une communauté de pratique effectuée par notre équipe vise notamment à partager ces modalités afin d’élargir l’activité de pharmacovigilance à l’échelle du Québec.
CONCLUSION
Pour donner une suite à l’obligation faite aux établissements de santé au Canada de déclarer les EIM graves, cet article décrit un programme original et complet de pharmacovigilance en établissement de santé.
Références
1 Loi sur les aliments et drogues, L.R.C. (1985), ch-F27. Publié au : https://lawslois.justice.gc.ca/fra/lois/f-27/TexteComplet.html. Consulté le 1ermai 2019.
2 Règlement modifiant le Règlement sur les aliments et drogues (rapports sur les réactions indésirables graves à une drogue — hôpitaux). La Gazette du Canada, partie I. 2018;152(24). Publié au : http://www.gazette.gc.ca/rp-pr/p1/2018/2018-06-16/html/reg5-fra.html. Consulté le 1er mai 2019.
3 Vers la déclaration obligatoire des réactions indésirables graves à un médicament et des incidents relatifs aux instruments médicaux par les établissements de soins de santé [document de consultation]. Ottawa (ON) : Gouvernement du Canada. Publié au : https://www.canada.ca/fr/sante-canada/programmes/consultation-declaration-obligatoire-reactions-indesirable-graves-medicament-instrument-medicaux/document.html. Consulté le 1er mai 2019.
4 Bussières JF, Merrill D. Chapitre B : Clinical pharmacy practice. Dans : Hospital pharmacy in Canada report 2016/17. pages 3–23. Ottawa (ON) : Société canadien des pharmaciens d’hôpitaux ; 2018. Publié au : http://hospitalpharmacysurvey.ca/hpc2/content/2018_report/Report%202018.pdf. Consulté le 1er mai 2019.
5 Canadian Pharmacogenomics Network for Drug Safety [homepage]. Vancouver (C.-B.) : Canadian Pharmacogenomics Network for Drug Safety. Publié au : http://cpnds.ubc.ca/. Consulté le 7 mai 2019.
6 Huet E, Closon A, Lebel D, Durand C, Bussières JF. Étude rétrospective de l’incidence des effets indésirables médicamenteux dans un centre hospitalier universitaire mère-enfant de 1989 à 2010. Ann Pharm Fr. 2011;69(6): 317–23.

7 Harry M, Lebel D, Comtois A, Bussières JF. Détection et codification des effets indésirables médicamenteux dans un centre hospitalier universitaire mère-enfant. Arch Pédiatr. 2017;24(12):1179–87.

8 Soyer J, Necsoiu D, Desjardins I, Lebel D, Bussières JF. Adverse drug reactions’ codification by medical record technicians and comparison with pharmacovigilance reporting: toward a solution to respect the requirements of Vanessa’s law [résumé]. Canadian Pharmacy Education and Research Conference de l’Association of Faculties of Pharmacy of Canada (AFPC), les 13 et 14 juin 2018, à Ottawa (Ontario).
9 Soyer J, Necsoiu D, Lebel D, Bussières JF. Codage des séjours patients par les archivistes médicaux du Centre hospitalier Sainte-Justine : une source inestimable de données pour le pharmacien. Pharmactuel. 2018;51(4):237–45.
10 Soyer J, Necsoiu D, Lebel D, Bussières JF. Comprendre la Classification Internationale des Maladies et la Classification Canadienne des Interventions: exemples d’utilisation pour le pharmacien hospitalier [résumé]. Congrès de l’Association des pharmaciens des établissements de santé du Québec (APES), les 25, 26 et 27 avril 2018, à Drummondville (Québec).
11 Rault P, Mégrourèche E, Labarre JS, Pettersen-Coulombe F, Lebel D, Bussières JF. Profil de la pratique de la pharmacovigilance en établissement de santé au Québec [résumé]. 8e colloque annuel du Réseau québécois de recherche sur les médicaments (RQRM), les 19 et 20 octobre 2018, à Montréal (Québec).
12 Rault P, Mégrourèche E, Labarre JS, Pettersen-Coulombe F, Lebel D, Bussières JF. Détermination des bonnes pratiques de pharmacovigilance en pharmacie hospitalière au Québec à l’aide d’une échelle d’évaluation selon une méthode Delphi modifiée [résumé]. 8e colloque annuel du Réseau québécois de recherche sur les médicaments (RQRM), les 19 et 20 octobre 2018, à Montréal (Québec).
13 He W, Yao D, Hu Y, Dai H. Analysis of a pharmacist-led adverse drug event management model for pharmacovigilance in an academic medical center hospital in China. Ther Clin Risk Manag. 2018;14:2139–47.


14 van Grootheest AC, de Jong-van den Berg LT. The role of hospital and community pharmacists in pharmacovigilance. Res Social Adm Pharm. 2005; 1(1):126–33.

15 Phansalkar S, Hoffman JM, Nebeker JR, Hurdle JF. Pharmacists versus non-pharmacists in adverse drug event detection: a meta-analysis and systematic review. Am J Health Syst Pharm. 2007;64(8):842–9.

16 Yu D, Sheets J, Suppes S, Goldman J. Characterization of severe adverse drug reactions at a free-standing children’s hospital. J Clin Pharmacol. 2019;59 (12):1569–72.

17 Morales Ríos O, Jasso Gutiérrez L, Talavera JO, Téllez-Rojo MM, Olivar López V, Garduño Espinosa J, et al. A comprehensive intervention for adverse drug reactions identification and reporting in a pediatric emergency department. Int J Clin Pharm. 2016;38(1):80–7.

18 Terblanche A, Meyer JC, Godman B, Summers RS. Impact of a pharmacist-driven pharmacovigilance system in a secondary hospital in the Gauteng Province of South Africa. Hosp Pract (1995). 2018;46(4):221–8.

19 Guédat MG, Gouraud A, Ramiah T, Demazière J, Delanoy B, Vial T, et al. Pharmacie clinique et pharmacovigilance à l’hôpital : bilan et perspectives après 9 ans d’expérience. Therapie. 2012;67(3):243–50.

20 Hadi MA, Neoh CF, Zin RM, Elrggal ME, Cheema E. Pharmacovigilance: pharmacists’ perspective on spontaneous adverse drug reaction reporting. Integr Pharm Res Pract. 2017;6:91–8.

Pauline Rault est assistante de recherche, Unité de recherche en pratique pharmaceutique, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec). Elle est aussi candidate au Pharm. D. au Faculté de pharmacie de Rennes 1, Rennes, France
Amélie Duhamel, BSBP, est assistante de recherche, Unité de recherche en pratique pharmaceutique, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec)
Dana Necsoiu est archiviste médicale, Département des archives, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec)
Isabelle Desjardins est archiviste médicale, Département des archives, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec)
Denis Lebel, B. Pharm., M. Sc., FCSHP, est pharmacien et chef-adjoint, Département de pharmacie, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec)
Jean-François Bussières, B. Pharm., M. Sc., MBA, FCSHP, FOPQ, est pharmacien et chef, Département de pharmacie et Unité de recherche en pratique pharmaceutique, Centre hospitalier universitaire Sainte-Justine, et professeur titulaire de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec)
Conflits d’intérêts: Aucun déclaré (
Return to Text
)
Adresse de correspondance: Pauline Rault Unité de recherche en pratique pharmaceutique, Département de pharmacie Centre hospitalier universitaire Sainte-Justine 3175, chemin de la Côte Sainte-Catherine Montréal QC H3T 1C5, Courriel:pauline.rlt@gmail.com
(Return to Top)
Financement: Aucun reçu. (
Return to Text
)
Canadian Journal of Hospital Pharmacy, VOLUME 73, NUMBER 1, January-February 2020